Kaliumchlorid ist eine anorganische Verbindung aus der Gruppe der Halogenide, die chemisch als das Kaliumsalz der Salzsäure beschrieben wird. In der Substanz liegt das Kalium in Form positiv geladener K+-Kationen und Chlor als negativ geladenene Chlorid-Anionen Cl- vor.
Bezeichnungen und Identifikatoren
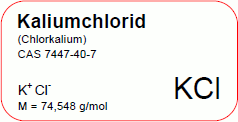
Kaliumchlorid
ClK
KCl
74,548 (g/mol)
7447-40-7
231-211-8
WCUXLLCKKVVCTQ-UHFFFAOYSA-M
Weitere Bezeichnungen, Synonyme
Sylvin; Chlorkalium; Digestivsalz; Kalium chloratum
INCI-Bezeichnung
Potassium chloride
Englische Bezeichnung
Potassium chloride
Muriate of potash; Sylvite; Potassium salt; Sylvine
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Kaliumchlorid:
ClK oder KCl
Mr = 74,5483 g/mol
SMILES: [Cl-].[K+]
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Kaliumchlorid. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
Reines Kaliumchlorid liegt in der Regel als weißes, geruchloses, stark salzig und leicht bitter schmeckendes, hygroskopisches Pulver bzw. als farblose, längliche, prismatische oder kubische Kristalle vor.
+ Gut löslich in Wasser (siehe unten), Glycerol.
- Unlöslich in Alkohol (0,00288 g/L bei 25 °C), Aceton und Ether.
770 °C
1420 °C
1,984 g cm-3 bei 20 °C
pK1s = -7
nD = 1,4902
-436 kJ/mol bei 25 °C
83 J/(mol K) bei 25 °C
-39,0 × 10-6 cm3 mol-1
Kubisch flächenzentriert, Raumgruppe Fm3m - Nr. 225; a = 629,2 pm. Jeweils oktaedrische Koordination der Ionen.
Kaliumchlorid-Lösung
Festes Kaliumchlorid ist in Abhängigkeit von der Temperatur gut wasserlöslich:
| Temperatur | Löslichkeit in g/L |
|---|---|
| 0 °C | 281 |
| 10 °C | 312 |
| 20 °C | 339,7 |
| 25 °C | 355 |
| 30 °C | 372 |
| 40 °C | 402 |
| 50 °C | 431 |
Eine vollständig gesättigte Kaliumchloridlösung erhält man bei 20 °C durch Lösen von 339,7 Gramm KCl im einem Liter Wasser. Der Siedepunkt dieser Lösung liegt bei 108,6 °C, die Dichte bei 1,18 g cm-3.
Die nachfolgende Tabelle bildet einige Daten und Eigenschaften (Stoffmengenkonzentration c (Molarität), Massenkonzentration β, Dichte ρ, Brechnungsindex nD) wäßriger Kaliumchlorid-Lösungen in Abhängigkeit vom Massenanteil an KCl ab. Die Werte gelten für eine Temperatur von 20 °C.
| Massen- prozente | c [mol/L] | β [g/L] | Molalität b [mol/kg] | Dichte ρ [g cm-3] | Brechungsindex nD |
|---|---|---|---|---|---|
| 0,5 % | 0,067 | 4,995 | 0,067 | 1,0014 | 1,3337 |
| 1 % | 0,135 | 10,064 | 0,135 | 1,0046 | 1,3343 |
| 2 % | 0,271 | 20,203 | 0,274 | 1,0110 | 1,3357 |
| 3 % | 0,409 | 30,490 | 0,415 | 1,0174 | 1,3371 |
| 4 % | 0,549 | 40,927 | 0,559 | 1,0239 | 1,3384 |
| 5 % | 0,691 | 51,513 | 0,706 | 1,0304 | 1,3398 |
| 6 % | 0,835 | 62,248 | 0,856 | 1,0369 | 1,3411 |
| 7 % | 0,980 | 73,057 | 1,010 | 1,0434 | 1,3425 |
| 8 % | 1,127 | 84,016 | 1,166 | 1,0500 | 1,3438 |
| 9 % | 1,276 | 95,124 | 1,327 | 1,0566 | 1,3452 |
| 10 % | 1,426 | 106,306 | 1,490 | 1,0633 | 1,3466 |
| 11 % | 1,579 | 117,712 | 1,658 | 1,0700 | 1,3479 |
| 12 % | 1,733 | 129,192 | 1,829 | 1,0768 | 1,3493 |
| 13 % | 1,890 | 140,896 | 2,004 | 1,0836 | 1,3507 |
| 14 % | 2,048 | 152,675 | 2,184 | 1,0905 | 1,3521 |
| 15 % | 2,208 | 164,603 | 2,367 | 1,0974 | 1,3535 |
| 16 % | 2,370 | 176,679 | 2,555 | 1,1043 | 1,3549 |
| 17 % | 2,534 | 188,905 | 2,747 | 1,1114 | 1,3563 |
| 18 % | 2,701 | 201,355 | 2,945 | 1,1185 | 1,3577 |
| 19 % | 2,869 | 213,879 | 3,147 | 1,1256 | 1,3592 |
| 20 % | 3,039 | 226,552 | 3,354 | 1,1328 | 1,3606 |
| 21 % | 3,211 | 239,375 | 3,566 | 1,1399 | 1,3622 |
| 22 % | 3,386 | 252,421 | 3,783 | 1,1474 | 1,3635 |
| 23 % | 3,562 | 265,541 | 4,007 | 1,1545 | 1,3651 |
| 24 % | 3,742 | 278,960 | 4,236 | 1,1623 | 1,3665 |
| 25 % | 3,924 | 292,528 | 4,471 | 1,1701 | 1,3679 |
In der Medizin verwendete Elektrolylösungen mit Kaliumchlorid wie die Ringer-Lösung enthalten 4 bis 5 mmol/L Kaliumionen.
Eine 3-molare bzw. 3M-KCl-Lösung (c = 3 mol/l) dient als Aufbewahrungs-Lösung für viele Arten von pH-Elektroden und ORP-Sonden; man erhält die Lösung aus 223,644 g Kaliumchlorid in einem Meßkolben und Auffüllen des Volumens auf einen Liter mit destillierten Wasser.
Die relative Feuchte über einer gesättigten KCl-Lösung in einem Behälter beträgt bei 23 °C konstant 85 %.
Leitfähigkeit
Kaliumchlorid-Lösungen leiten temperatur- und konzentrationsabhängig den elektrischen Strom. Sie werden - neben anderen Salzlösungen - zur Kalibrierung von Leitfähigkeitsmessgeräten herangezogen. Die elektrische Leitfähigkeit (Leitwerte κ in Millisiemens pro cm) verschiedener KCl-Lösungen sind in den nachfolgenden Tabellen dargestellt.
Die erste Tabelle führt die Leitfähigkeit einer Kaliumchlorid-Lösung in Abhängigkeit von den Massenprozenten KCl an der wäßrigen Lösung auf; alle Werte gelten für eine Temperatur von 20 °C:
| Masse-% KCl | g/L | kappa κ in mS/cm |
|---|---|---|
| 0,5 | 4,995 | 8,2 |
| 1 | 10,064 | 15,7 |
| 2 | 20,203 | 29,5 |
| 5 | 51,513 | 71,9 |
| 10 | 106,306 | 143 |
| 15 | 164,604 | 208 |
Die zweite Tabelle listet typische Werte zum Ansetzen einer Kalibrierlösung (in Gramm KCl pro Liter reines destilliertes Wasser) auf. Die Daten beziehen sich auf eine Temperatur von 25 °C:
| g/L | mol/L | κ in mS/cm |
|---|---|---|
| 0 | 0 | 0,02 |
| 0,0417 | 0,00056 | 0,084 |
| 0,0745 | 0,001 | 0,700 |
| 0,7454 | 0,01 | 1,413 |
| 1,4909 | 0,02 | 2,765 |
| 2,9819 | 0,04 | 5,446 |
| 7,4548 | 0,10 | 12,880 |
| 37,2741 | 0,50 | 56,6 |
| 74,5483 | 1,00 | 111,8 |
| 110,0966 | 2,00 | 212,0 |
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Kaliumchlorid - ClK - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Chlor
35Cl: 34,96885 u [75,80 %]
36Cl: 35,96831 u [<< 1 %]
37Cl: 36,9659 u [24,2 %]
35Cl: 36,04522 %
36Cl: Spuren
37Cl: 11,50784 %
Kalium
39K: 38,96371 u [93,2581 %]
40K: 39,964 u [0,0117 %]
41K: 40,96183 u [6,7302 %]
39K: 48,91102 %
40K: 0,00614 %
41K: 3,52978 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 74,5483 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 13,414 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,013 mol.
Monoisotopische Masse: 73,932559175 Da - bezogen auf 35Cl39K.
Synthese, Gewinnung
Kaliumchlorid wird überwiegend aus den Mineralien Sylvit und Carnallit (Kali-Bergbau) oder auch aus Salzwasser gewonnen. Darüber hinaus ist es Nebenprodukt bei der Synthese von Salpetersäure aus Kaliumnitrat. Der größte Teil des global benötigten Kaliumchlorids wird in Saskatchewan, Kanada sowie in Russland und Weißrussland als Kali in landwirtschaftlicher und industrieller Qualität gewonnen. Allein die kanadische Provinz Saskatchewan produzierte 2017 über 25% der weltweiten Kaliproduktion.
Im Labor lässt sich das Salz durch Umsetzung equivalenter Mengen von Salzsäure und Kaliumhydroxid gewinnen.
Verwendung
Kaliumchlorid ist ein vielfältig genutztes Salz in Industrie, Landwirtschaft, Ernährung und Medizin. Gelegentlich wird die Chemikalie mit Zusatzstoffen zur Verhinderung des Zusammenbackens bzw. Verklumpens mit Magnesiumcarbonat, Siliciumdioxid oder anderen Verdindungen versetzt (Kennzeichung: Mit Antiback bzw. Antibackmittel) in den Handel gebracht.
Der Großteil des industriell produzierten Kaliumchlorids wird zur Herstellung von Düngemitteln verwendet, die als Kali-Dünger bezeichnet werden und den für das Wachstum von Pflanzen benötigten Mineralstoff Kalium liefern.
Wirkstoff Kaliumchlorid
ATC-Code:A12BA01
A12BA51
B05XA01
Kaliumchlorid wird zur Behandlung von Hypokaliämie (Kaliummangel im Blut) als Quelle für den Mineralstoff Kalium medizinisch eingesetzt. Die Substanz ist zudem Bestandteil verschiedener Elektrolyt-Lösungen wie zum Beispiel der Ringer-Lösung und Additiv in Peritonealdialyse-Lösungen. Eine Überdosierung kann zu einer Hyperkaliämie führen, die die Signalübertragung der Zellen in erheblichen Maße stören kann.
Detail-Informationen zum Wirkstoff in englischer Sprache: Siehe unter DrugBank DB00761 (Wirkstoff-Datenbank).
Verwendung in Lebensmitteln
E-Nummer: E508
Kaliumchlorid ist in der EU ein zugelassener Lebensmittel-Zusatzstoff in der Funktion als Geschmacksverstärker. Die Substanz wird hauptsächlich in Fertiggerichten, Gewürzmischungen, natriumarmen oder kalorienreduzierten Gerichten und Speisesalzen eingesetzt. Eine Begrenzung der Höchstmenge gibt es nicht (quantum satis).
EU: Status und Vorschriften siehe EU Food Additives DB Ref.-Nummer 3206.
Verwendung in Kosmetika
INCI-Bezeichnung: Potassium chloride
Zugelassener Inhaltsstoff von Kosmetika und Körperpflegeprodukten zur Regelung der Viskosität der Zubereitung.
Quelle: CosIng (Cosmetic Ingredient Database der EU) Nummer: 36948.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Kaliumchlorid als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[0] - Fach- und Forschungsartikel in wissenschaftlichen Zeitschriften via PubMed: Potassium_chloride.
[1] - Maged Younes, Gabriele Aquilina, Laurence Castle et al.:
Re‐evaluation of hydrochloric acid (E 507), potassium chloride (E 508), calcium chloride (E 509) and magnesium chloride (E 511) as food additives.
In: EFSA Journal, (2019), DOI 10.2903/j.efsa.2019.5751.
Letzte Änderung am 08.08.2024.
Permalink: https://www.internetchemie.info/substanz/Kaliumchlorid.php
© 1996 - 2026 Internetchemie ChemLin