Bleinitrat ist eine anorganische Verbindung, die chemisch als das Salz des zweiwertigen Elements Blei und der Salpetersäure beschrieben wird.
Bleinitrat wurde erstmals 1597 von dem Alchemisten Andreas Libavius identifiziert, der die Substanz plumbum dulce , was - bezogen auf den Geschmack der Substanz - soviel wie süßes Blei bedeutet.
Bezeichnungen und Identifikatoren
Bleinitrat
N2O6Pb
Pb(NO3)2
331,208 (g/mol)
10099-74-8
233-245-9
RLJMLMKIBZAXJO-UHFFFAOYSA-N
Systematischer Name
Blei(II)-dinitrat
Weitere Bezeichnungen, Synonyme
Blei(II)-nitrat; Salpetersäure Bleisalz; Bleidinitrat
Englische Bezeichnung
Lead dinitrate
Lead (II) nitrate
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Bleinitrat:
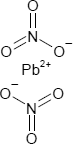
N2O6Pb oder Pb(NO3)2
Mr = 331,208 g/mol
Blei(II)-dinitrat
SMILES: [N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Pb+2]
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Bleinitrat. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
In reiner Form liegt Blei(II)-nitrat als weißes Pulver oder in Form farbloser kubischer Kristalle vor, die leicht in Wasser löslich sind und süß schmecken.
470 °C
4,53 g cm-1 bei 20 °C
Bleinitrat kristallisiert im kubischen System, Raumgruppe Pa3, Nr. 205, wobei jede Seite des Würfels 784 pm lang ist. Ein fürheres Forschungsinteresse an der Kristallstruktur von Blei(II)-nitrat beruhte teilweise auf der Möglichkeit einer freien Innenrotation der Nitratgruppen innerhalb des Kristallgitters bei erhöhten Temperaturen, was jedoch nicht beobachtet werden konnte [Heger et al. 1986].
Spektroskopische Daten:
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Bleinitrat - N2O6Pb - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Stickstoff
ΣAr = 28,014 u
14N: 14,00307 u [99,6205 %]
15N: 15,00011 u [0,3795 %]
14N: 8,42603 %
15N: 0,0321 %
Sauerstoff
ΣAr = 95,994 u
16O: 15,99491 u [99,757 %]
17O: 16,99913 u [0,03835 %]
18O: 17,99916 u [0,205 %]
16O: 28,91257 %
17O: 0,01111 %
18O: 0,05942 %
Blei
204Pb: 203,97304 u [1,4 %]
206Pb: 205,97447 u [24,1 %]
207Pb: 206,9759 u [22,1 %]
208Pb: 207,97665 u [52,4 %]
204Pb: 0,87582 %
206Pb: 15,07669 %
207Pb: 13,82551 %
208Pb: 32,78085 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 331,208 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 3,019 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,003 mol.
Monoisotopische Masse: 331,9522887225 Da - bezogen auf 14N216O6208Pb.
Synthese, Gewinnung
Blei(II)-nitrat wird kommerziell durch die Reaktion von metallischem Blei mit konzentrierter Salpetersäure hergestellt, in der es schwer löslich ist.
Gängige Labormethode ist die Umsetzung von Bleimetall, Bleimonoxid oder Bleicarbonat mit verdünnter Salpetersäure und anschließender Aufkonzentrierung. Ein Überschuss an Säure unterdrückt die Bildung basischer Nitrate.
Verwendung
Bleinitrat ist seit dem Mittelalter bekannt und war Basis für die Herstellung anderer Blei-Verbindungen. Im 19. Jahrhundert wurde in Europa und den Vereinigten Staaten mit der kommerziellen Herstellung Bleisalzes begonnen. Historisch gesehen war die Hauptverwendung als Rohstoff bei der Herstellung von Pigmenten für Bleilacke. So wie viele andere Bleiverbindungen wurde auch Bleinitrat früher in einer Vielzahl industrieller Verarbeitungstechniken und Produkten eingesetzt, die heute auf Grund der Toxizität und der Umweltgefährlichkeit weitgehend obsolet sind. Hierzu gehören unter anderem:
Herstellung von Streichhölzern und Spezialsprengstoffen. Als Beizmittel beim Färben und Bedrucken von Textilien, zum Färben von Horn, Perlmutt. Oxidationsmittel in der Farbstoffindustrie. Sensibilisator in der Fotografie. Elektrolytische Raffination von Blei. Als Flotationsmittel bei der Titanentfernung aus Tonen und der Gewinnung von Rotblei. Hitzestabilisator in Nylon und Polyestern, als Beschichtung für fotothermografisches Papier und in Rodentiziden. Bei der Goldcyanidierung (Cyanidlaugerei zur Gewinnung von Gold) optimiert die Zugabe von Blei(II)-nitratlösung den Auslaugungsprozess.
Das Erhitzen von Bleinitrat ist eine alte Methode zur Herstellung von Stickstoffdioxid:
2 Pb(NO3)2 → 2 PbO + 4 NO2 + O2.
Bleinitrat wurde früher als Ätzmittel bei so genanntem Pferdekrebs (Equine Sarkoide) verwendet.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)





Signalwort: Gefahr
Gefahrenhinweise (H-Sätze):
- H272
Kann Brand verstärken; Oxidationsmittel. - H302
Gesundheitsschädlich bei Verschlucken. - H317
Kann allergische Hautreaktionen verursachen. - H318
Verursacht schwere Augenschäden. - H332
Gesundheitsschädlich bei Einatmen. - H351
Kann vermutlich Krebs erzeugen. - H360
Kann die Fruchtbarkeit beeinträchtigen oder das Kind im Mutterleib schädigen. - H372
Schädigt die Organe bei längerer oder wiederholter Exposition. - H400
Sehr giftig für Wasserorganismen. - H410
Sehr giftig für Wasserorganismen, mit langfristiger Wirkung.
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.030.210 sowie Informationen zu REACh unter ECHA Chem 100.030.210.
Zur Toxikologie und zum Arbeitsschutz beim Umgang mit Bleinitrat sowie Maßnahmen im Gefahrenfall siehe: Gefahrstoffinformationssystem GESTIS, ZVG-Nr. 004400.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Bleinitrat als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[1] - H. Nowotny, G. Heger:
Structure refinement of lead nitrate.
In: Acta Crystallographica Section C, (1986), DOI 10.1107/S0108270186097032.
Letzte Änderung am 18.02.2024.
Permalink: https://www.internetchemie.info/substanz/Bleinitrat.php
© 1996 - 2026 Internetchemie ChemLin