Antimontrifluorid ist eine anorganisch chemische Verbindung, die chemisch als das Fluorid des dreiwertigen Elements Antimon charakterisiert wird.
Bezeichnungen und Identifikatoren
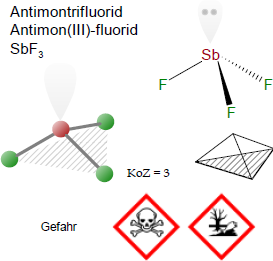
Antimontrifluorid
F3Sb
SbF3
178,755 (g/mol)
7783-56-4
232-009-2
GUNJVIDCYZYFGV-UHFFFAOYSA-K
Systematischer Name
Trifluorstiban
Weitere Bezeichnungen, Synonyme
Trifluorstibin
Englische Bezeichnung
Antimony trifluoride
Antimony(III) fluoride; Antimony(3+) trifluoride; Trifluorostibane; Trifluoroantimony; Trifluorostibine
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Antimontrifluorid:
F3Sb oder SbF3
Mr = 178,7552 g/mol
Trifluorstiban
SMILES: F[Sb](F)F
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Antimontrifluorid. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
Antimontrifluorid ist in reinem Zustand und unter Standardbedingungen ein weißer bis grauer, kristalliner, hygroskopischer, nicht brennbarer Feststoff, der an der Luft langsam zerließt und im Laufe der Zeit Glas angreift.
+ Gut löslich in Wasser, Methanol, Aceton.
- Unlöslich in Ammoniak.
292 °C
376 °C
4,379 g cm-3 bei 20 °C
26,34 kPa am Schmelzpunkt
-915,5 kJ/mol bei 25 °C
-22.8 kJ/mol vei 292 °C
-46,0 × 10-6 cm3 mol-1
Orthorhombisch, Raumgruppe C2cm Nr. 40, 4 mit den Gitterkonstanten a = 495 pm, b = 746 pm und c = 726 pm.
Jedes Antimonatom hat drei benachbarte Fluor-Atome mit mittleren Sb-F-Abständen von 192 pm. Diese SbF3-Einheiten sind über drei Fluorbrücken (Sb-F mit 261 pm) verbunden, um ein dreidimensionales Netzwerk mit einer stark verzerrten oktaedrischen Koordination um das Antimonatom zu bilden [1].
Spektroskopische Daten:
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Antimontrifluorid - F3Sb - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Fluor
ΣAr = 56,995209489 u
19F: 18,9984 u [100 %]
19F: 31,8845 %
Antimon
121Sb: 120,90381 u [57,21 %]
123Sb: 122,90421 u [42,79 %]
121Sb: 38,96888 %
123Sb: 29,14662 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 178,755209489 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 5,594 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,006 mol.
Monoisotopische Masse: 177,899019489 Da - bezogen auf 19F3121Sb.
Synthese, Gewinnung
Das Antimon(III)-fluorid kann durch Behandeln von Antimontrioxid oder Antimontrichlorid mit Fluorwasserstoff (als Säure) hergestellt werden. Das reine Produkt wird dann durch vorsichtiges Verdampfen des gesamten Wassers aus dem Rohprodukt gewonnen, welches anschließend sublimiert wird.
Eine historische Reaktion ist die Destillation einer Mischung aus metallischem Antimon und Quecksilberfluorid, wobei neben elementarem Quecksilber das Trifluorid entsteht.
Verwendung
Die Industrie verwendet die Antimon-Verbindung in der Färberei und zur Herstellung von Fluorid-Glas, Keramik und Porzellan.
Die Chemikalie wird in der Chemie als Katalysator bei Fluorierungen mit Fluorwasserstoff sowie zur Herstellung fluorierter Verbindungen eingesetzt.
Swarts-Reagenz
Eine Mischung aus Antimontrifluorid und Chlor wird auch als Swarts-Reagenz bezeichnet. Bei der Swarts-Reaktion wird ein organisches Polyhalogenid mit dem Reagenz fluoriert. Die Bedeutung dieser chemischen Reaktion liegt der Umwandlung von organische. Chlor-Verbindungen in die entsprendenden Fluor-Verbindungen durch den Austausch der Halogen-Atome gegen F.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)


Signalwort: Gefahr
Gefahrenhinweise (H-Sätze):
- H301
Giftig bei Verschlucken. - H311
Giftig bei Hautkontakt. - H331
Giftig bei Einatmen. - H411
Giftig für Wasserorganismen, mit langfristiger Wirkung.
LD50 (Maus, oral): 804 mg/kg.
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.029.099 sowie Informationen zu REACh unter ECHA Chem 100.029.099.
Zur Toxikologie und zum Arbeitsschutz beim Umgang mit Antimontrifluorid sowie Maßnahmen im Gefahrenfall siehe: Gefahrstoffinformationssystem GESTIS, ZVG-Nr. 500002.
Beförderung gefährlicher Güter (Gefahrgut-Kennzeichnung): UN-Nummer 2923.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Antimontrifluorid als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[1] - A. J. Edwards:
Fluoride crystal structures. Part XIV. Antimony trifluoride: a redetermination.
In: Journal of the Chemical Society A, (1970), DOI 10.1039/J19700002751.
Letzte Änderung am 12.02.2024.
Permalink: https://www.internetchemie.info/substanz/Antimontrifluorid.php
© 1996 - 2026 Internetchemie ChemLin