Antimontrichlorid ist eine binäre anorganisch-chemische Verbindung aus den Elementen Chlor und Antimon, die der Stoffgruppe der Chloride (Salze der Salzsäure) zugeordnet wird.
Bezeichnungen und Identifikatoren
Antimontrichlorid
Cl3Sb
SbCl3
228,11 (g/mol)
10025-91-9
233-047-2
FAPDDOBMIUGHIN-UHFFFAOYSA-K
Systematischer Name
Trichlorostiban
Weitere Bezeichnungen, Synonyme
Antimon(III)-chlorid; Trichlorstibin; Spießglanzbutter; Antimonbutter; Antimonchlorür
Englische Bezeichnung
Antimony trichloride
Trichlorostibane; Trichlorostibine; Butter of antimony; Antimony(III) chloride; Antimonous chloride
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Antimontrichlorid:
Cl3Sb oder SbCl3
Mr = 228,11 g/mol
Trichlorostiban
SMILES: Cl[Sb](Cl)Cl
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Antimontrichlorid. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
Antimontrichlorid liegt in reinem, frisch präpariertem Zustand in Form farbloser, orthorhombischer Kristalle vor, die stark hygroskopisch sind und schnell zu einer farblosen, weichen Masse zerfliessen, an der Luft rauchen und einen stechenden Geruch aufweisen. Die Chemikalie ist in Wasser gut löslich, wobei konzentrierte Lösungen beständiger sind; in verdünnter Lösung reagiert SbCl3 zu Antimonoxychlorid und HCl. Wegen der Hydrolyse-Neigung muss Antimontrichlorid vor Luftfeuchtigkeit geschützt aufbewahrt werden. Wirkt ätzend bzw. korrosiv auf Metalle und verschiedene Gewebe.
Das Chlorid schmilzt oberhalb von 73 °C; die Schmelze ist eine gelbliche ölige Flüssigkeit.
+ Sehr gut löslich in Wasser; löslich in vielen Lösungsmitteln wie Aceton, Benzol, Dioxan, Ethanol, Schwefelkohlenstoff, Tetrachlorkohlenstoffetc.
- Unlöslich in Pyridin, Chinolin und anderen organischen Basen.
73,4 °C
223,5 °C
3,14 g cm-3 bei 25 °C
2,51 g cm-3 bei 150 °C
nD = 1,46
-381,2 kJ/mol bei 25 °C
110,5 J/(mol K) bei 25 °C
-322,5 kJ/mol
0,1833 kJ/(mol K)
3,93 bei 20 °C
5,34
(Dielektrizitätskonstante)
-86,7 × 10-6 cm3 mol-1
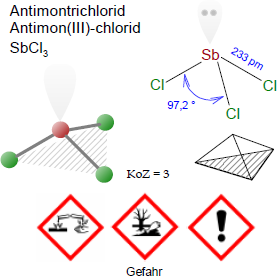
In der Gasphase ist das Molekül des Antimontrichlorids pyramidenförmig mit einem Cl-Sb-Cl-Winkel von 97,2° und einer Bindungslänge von 233 pm. Im Feststoff ist jedes Sb-Atom von drei Cl-Atomen in einem Abstand von 234 pm und darüber hinaus von fünf weiteren benachbarten Chlor-Atomen - zwei bei 346 pm, eines bei 361 pm und zwei bei 374 pm - umgeben. Diese acht Atome können als ein zweiseitiges trigonales Prisma betrachtet werden.
Spektroskopische Daten:
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Antimontrichlorid - Cl3Sb - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Chlor
ΣAr = 106,35 u
35Cl: 34,96885 u [75,80 %]
36Cl: 35,96831 u [<< 1 %]
37Cl: 36,9659 u [24,2 %]
35Cl: 35,33966 %
36Cl: Spuren
37Cl: 11,28258 %
Antimon
121Sb: 120,90381 u [57,21 %]
123Sb: 122,90421 u [42,79 %]
121Sb: 30,53741 %
123Sb: 22,84034 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 228,11 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 4,384 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,004 mol.
Monoisotopische Masse: 225,81036807 Da - bezogen auf 35Cl3121Sb.
Synthese, Gewinnung
Antimontrichlorid kann durch Reaktion von Chlor mit elementarem Antimon, Antimontribromid, Antimontrioxid oder Antimontrisulfid hergestellt werden. Eine alternative Methode ist die Umsetzung von Antimontrioxid mit konzentrierter Salzsäure.
Verwendung
Die Antimon-Verbindung wird als Reagenz zum qualitativen Nachweis von Vitamin A und anderen verwandten Carotinoiden verwendet; SbCl3 reagiert mit dem Carotinoid zu einem blauen Komplex, der kolorimetrisch gemessen werden kann. Die Reaktion ist unter dem Namen Carr-Price-Test bekannt.
Lösungen von Antimontrichlorid wurden früher als Enthornungsmittel bei Kälbern und Ziegen sowie gegen Fußfäule bei Hunden verwendet.
In der Chemie spielt die Substanz eine Rolle aus Ausgangssubstanz für andere Sb-Verbindungen, als Lewis-Säure, als Apoptose-Induktor und als kolorimetrisches Reagenz sowie als Katalysator bei der Polymerisation von Kohlenwasserstoffen und der Chlorierung von Olefinen. Als Bestandteil von Endprodukten dient die Chemikalie als Flammschutzmittel in Textilien, Kunststoffen.
Antimontrichlorid soll illegal auch als Verfälschungsmittel von Spirituosen eingesetzt worden sein, nämlich um den so genannten Louche-Effekt (Ouzo-Effekt) - die milchige (=Louche) Öl-in-Wasser- Emulsion, die entsteht, wenn Wasser zu Ouzo und anderen Likören und Spirituosen mit Anisgeschmack wie Pastis, Raki, Arak, Sambuca hinzugefügt wird - in Absinth zu verstärken.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)



Signalwort: Gefahr
Gefahrenhinweise (H-Sätze):
- H314
Verursacht schwere Verätzungen der Haut und schwere Augenschäden. - H411
Giftig für Wasserorganismen, mit langfristiger Wirkung.
LD50 (Ratte, oral): 525 mg/kg.
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.030.031 sowie Informationen zu REACh unter ECHA Chem 100.030.031.
Zur Toxikologie und zum Arbeitsschutz beim Umgang mit Antimontrichlorid sowie Maßnahmen im Gefahrenfall siehe: Gefahrstoffinformationssystem GESTIS, ZVG-Nr. 500001.
Beförderung gefährlicher Güter (Gefahrgut-Kennzeichnung): UN-Nummer 1733.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Antimontrichlorid als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Letzte Änderung am 12.02.2024.
Permalink: https://www.internetchemie.info/substanz/Antimontrichlorid.php
© 1996 - 2026 Internetchemie ChemLin