Sulfaminsäure - auch bekannt als Amidosulfonsäure bzw. Amidoschwefelsäure - ist eine anorganisch-chemische Verbindung und Stammverbindung der Gruppe der Sulfaminsäuren.
Das Molekül besteht aus einem zentralen Schwefelatom, das kovalent über Einfachbindungen mit einer Hydroxy- und Amino-Gruppe sowie durch Doppelbindungen mit zwei Sauerstoffatome verbunden ist. Die Bindungsabstände betragen 144 pm für S=O und 177 pm für SN; ie größere Länge des SN-Bindung stimmt mit einer Einfachbindung überein. Darüber hinaus wurden in einer Neutronenbeugungsstudie die Wasserstoffatome lokalisiert, die alle drei mit 103 pm gleich weit vom Stickstoff entfernt sind [1]. Im festen Zustand ist das Sulfaminsäuremolekül damit durch eine zwitterionische Formel +H3N-SO3− gut beschrieben (siehe auch Formelbild).
Die Salze und Ester der Sulfaminsäure heissen Sulfamate.
Bezeichnungen und Identifikatoren
Sulfaminsäure
H3NO3S
97,088 (g/mol)
5329-14-6
226-218-8
IIACRCGMVDHOTQ-UHFFFAOYSA-N
Weitere Bezeichnungen, Synonyme
Sulfamidsäure; Amidosulfonsäure; Amisoschwefelsäure; Sulfamsäure
Englische Bezeichnung
Sulfamic acid
Amidosulfonic acid; Amidosulfuric acid; Amidohydroxidodioxidosulfur; Sulfuramidic acid
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Sulfaminsäure:
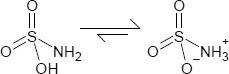
H3NO3S
Mr = 97,088 g/mol
SMILES: NS(=O)(=O)O
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Sulfaminsäure. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
In reinem Zustand und unter Standardbedingungen hat die Sulfaminsäure das Aussehen eines farb- und geruchlosen, weißen Pulvers bzw. farbloser, orthorhombischer Kristalle, die wasserlöslich sind und sich beim Erhitzen über den Schmelzpunkt schnell zu Wasser, Schwefeltrioxid, Schwefeldioxid und Stickstoff zersetzten. An der der feuchten Luft und im Wasser hydrolysiert die Säure langsam zu Ammoniumhydrogensulfat. Im trockenem Zustand und in gut verschlossenen Gefäßen ist die Chemikalie stabil unbegrenzt haltbar.
+ Leicht löslich in Wasser (213 g/L bei 20 °C), DMSO, Formamid, Ammoniak.
- Wenig löslich in Aceton (4g/L bei 25 °C), Methanol (U41,2 g/L bei 25 °C); unlöslich in Kohlenwasserstoffen.
- Verteilungskoeffizient logP = 0,10.
205 °C
2,13 g cm-3 bei 20 °C
pK1s = 1,01 bei 25 °C
0,78 Pa bei 20 °C
Spektroskopische Daten:
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Sulfaminsäure - H3NO3S - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Wasserstoff
ΣAr = 3,024 u
1H: 1,00783 u [99,99 %]
2H: 2,0141 u [0,01 %]
3H: 3,01605 u [<< 1 %]
1H: 3,11439 %
2H: 0,00031 %
3H: Spuren
Stickstoff
14N: 14,00307 u [99,6205 %]
15N: 15,00011 u [0,3795 %]
14N: 14,37237 %
15N: 0,05475 %
Sauerstoff
ΣAr = 47,997 u
16O: 15,99491 u [99,757 %]
17O: 16,99913 u [0,03835 %]
18O: 17,99916 u [0,205 %]
16O: 49,31646 %
17O: 0,01896 %
18O: 0,10135 %
Schwefel
32S: 31,97207 u [94,954 %]
33S: 32,97146 u [0,763 %]
34S: 33,96787 u [4,365 %]
35S: 34,96903 u [<< 1 %]
36S: 35,96708 u [0,016 %]
32S: 31,35532 %
33S: 0,25195 %
34S: 1,44139 %
35S: Spuren
36S: 0,00528 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 97,088 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 10,3 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,01 mol.
Monoisotopische Masse: 96,983364131351 Da - bezogen auf 1H314N16O332S.
Synthese, Gewinnung
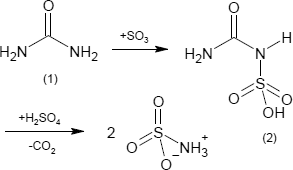
Die industrielle Synthese der Sulfaminsäure erfolgt in einer zweistufigen Reaktion durch Umsetzung von Harnstoff (1) mit Oleum - einem wasserfreien Gemisch aus Schwefeltrioxid und Schwefelsäure - mit Carbamoylsulfaminsäure (2) als Zwischenstufe.
Verwendung
Als feste oder flüssige Amidosulfonsäure (10 bis 15 %) findet die Chemikalie Anwendung als Entkalker im Haushalt bzw. als Bestandteil von Fertig-Kalklösemitteln und Sanitärreinigern, als Entkalkungsmittel in der Industrie sowie als Rostlöser. Im Vergleich zu den meisten üblichen starken Mineralsäuren weist Sulfaminsäure wünschenswerte Wasserentkalkungseigenschaften, geringe Flüchtigkeit und geringe Toxizität auf. Es bilden sich wasserlösliche Ca- bzw. Fe(III)-Salze.
Die Sulfaminsäure und ihre Salze ist wichtiges Ausgangsprodukt bei der Synthese verschiedener Chemikalien wie zum Beispiel Natriumcyclamat (ein Süßstoff), einige Antibiotika, Farbstoffe, Pigmente, Herbizide, Lachgas, pharmazeutischen Wirkstoffen u. v. m.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)

Signalwort: Achtung
Gefahrenhinweise (H-Sätze):
- H315
Verursacht Hautreizungen. - H319
Verursacht schwere Augenreizung. - H412
Schädlich für Wasserorganismen, mit langfristiger Wirkung.
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.023.835 sowie Informationen zu REACh unter ECHA Chem 100.023.835.
Zur Toxikologie und zum Arbeitsschutz beim Umgang mit Sulfaminsäure sowie Maßnahmen im Gefahrenfall siehe: Gefahrstoffinformationssystem GESTIS, ZVG-Nr. 003180.
Externe Informationsquellen
Hersteller und Bezugsquellen
Sulfaminsäure als kommerzielles Produkt von international tätigen Lieferanten und Suche nach Analoga siehe unter: ZINC000238809066.
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Sulfaminsäure als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[0] - Fach- und Forschungsartikel in wissenschaftlichen Zeitschriften via PubMed: Sulfamic_acid.
[1] - R. L. Sass:
A neutron diffraction study on the crystal structure of sulfamic acid.
In: Acta Crystallographica, (1960), DOI 10.1107/S0365110X60000789.
Letzte Änderung am 18.04.2024.
Permalink: https://www.internetchemie.info/substanz/Sulfaminsäure.php
© 1996 - 2026 Internetchemie ChemLin