Calcium ist ein chemisches Element aus der Gruppe der Erdalkalimetalle mit dem Elementsymbol Ca und der Ordnungszahl 20. Die frisch angeschnittene Oberfläche der metalls glänzt silberweiß und läuft an der Luft schnell an.
Übersicht: Allgemeine Daten zum Calcium
Das Calcium-Atom
Identifikations-Merkmal für das Ca-Atom - und somit für das Element Calcium - ist das Vorhandensein von 20 Protonen im Atomkern; man nennt diese Zahl Kernladungszahl oder Protonenzahl und sie entspricht der Ordnungszahl, die wiederum die Stellung des Calciums im Periodensystem bestimmt. Im ungeladenen und damit elektrisch neutralen Ca-Atom befinden sich zudem 20 Elektronen in der Elektronhülle.
Für Unterschiede bei den Calcium-Atomkernen bei gleichbleibender Kernladungszahl sorgen die Kernbausteine der Neutronen. Diese Atomsorten werden unter dem Begriff Calcium-Isotope bzw. Calcium-Nuklide zusammengefasst (Isotopen-Daten: siehe dort).
Die irdischen Calcium-Vorkommen bestehen aus einem Gemisch aus 7 Nukliden unterschiedlicher Masse; die relative Atommasse wird daher mit 40,078(4) u angegeben.
Elektronenkonfiguration
| Symbol | OZ | Kurzform | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f |
| Ca | 20 | [Ar] 4s2 | 2 | 2 | 6 | 2 | 6 | 2 |
Ionisierungsenergien
Die folgende Tabelle listet die Bindungsenergien bzw. die Ionisierungsenergien IE des Calciums auf, also die erforderliche Energie in Elektronenvolt (eV), um ein bestimmtes Elektron von einem Ca-Atom zu trennen.
| 1. IE: | 6,11316 eV | 2. IE: | 11,87172 eV | 3. IE: | 50,9135 eV | 4. IE: | 67,27 eV | 5. IE: | 84,50 eV | 6. IE: | 108,78 eV |
| 7. IE: | 127,2 eV | 8. IE: | 147,24 eV | 9. IE: | 188,54 eV | 10. IE: | 211,277 eV | 11. IE: | 591,9 eV | 12. IE: | 657,2 eV |
| 13. IE: | 726,6 eV | 14. IE: | 817,6 eV | 15. IE: | 894,5 eV | 16. IE: | 974 eV | 17. IE: | 1087 eV | 18. IE: | 1157,8 eV |
| 19. IE: | 5128,8 eV | 20. IE: | 5469,9 eV | 21. IE: | eV | 22. IE: | eV | 23. IE: | eV | 24. IE: | eV |
Elektronenbindungsenergie
Die nachfolgende Tabelle listet die Elektronenbindungsenergien der einzelnen Calcium-Elektronen in den jeweiligen Orbitalen auf. Die Werte sind in Elektronenvolt (eV) angegeben.
| K | LI | LII | LIII |
| 1s | 2s | 2p1/2 | 2p3/2 |
| 4038,5 | 438,4 | 349,7 | 346,2 |
| MI | MII | MIII | MIV | MV |
| 3s | 3p1/2 | 3p3/2 | 3d3/2 | 3d5/2 |
| 44,3 | 25,4 | 25,4 |
Weitere Daten
180 pm (empirisch, nach Slater)
171 pm (in Einfach-Bindungen, nach Pyykkö et al.)
147 pm (in Zweifach-Bindungen, nach Pyykkö et al.)
133 pm (in Dreifach-Bindungen, nach Pyykkö et al.)
Spektrallinien des Calciums
Emissionsspektrum des Cacliums mit den charakteristischen Spektrallinien im sichtbaren Wellenlängenbereich zwischen 400 und 700 nm. Besonders gut sichtbar sind die beiden Hauptlinien bei 622,0 und 553,3 nm. Calcium und seine Verbindungen können an Hand dieser scharfen Linien mittels Flammenphotometrie nachgewiesen werden. Die Flammprobe ergibt eine ziegelrote Flamenfärbung in Anwesenheit von Ca.

Chemie des Calciums
Calcium zeigt sich als typisches Erdalkalimetall, dessen chemisches Verhalten von den beiden Valenzelektronen bestimmt wird; es tritt fast ausschließlich in der Oxidationsstufe +II auf. Mit den Luftbestandteilen Sauerstoff und Stickstoff reagiert das blanke Metall bald zu einem Gemisch aus Calciumoxid CaO und Calciumnitrid Ca3N2; letztere Substanz reagiert in Gegenwart von Luftfeuchtigkeit weiter zu Calciumhydroxid Ca(OH)2 und Ammoniak NH3.
Calcium in Stücken ist weniger reaktiv als in fein verteilter Form; feines Calcium oder -Staub verbrennt spontan an der Luft.
Mit Wasser reagiert das unedle Metall rasch unter Bildung von Calciumhydroxid und unter Abgabe von Wasserstoff - schneller als das leichtere Magnesium und langsamer als Strontium.
Chemische Daten
1,04 nach Allred-Rochow
1,034 nach Allen
1,06 nach Sanderson
2,6965 eV nach Gosh-Gupta
2,2 eV nach Pearson
Standardpotentiale
Normalpotential des Calciums:
| E0 (V) | Nox | Name Ox. | Ox. | e- | ⇔ | Red. | Name Red. | Nox |
| -2,868 | + II | Calcium-Kation | Ca2+ | + 2 e- | ⇔ | Ca (s) | Calcium | 0 |
Material- und physikalische Eigenschaften des Calciums
Die nachfolgende Tabelle führt einige physikalische Daten sowie Materialeigenschaften des reinen Calcium-Metalls auf.
0,647 J g-1 K-1 (spezifisch)
1,378 g cm-3 (flüssig, am Schmelzpunkt)
nach Brinell: 0,167 GPa
nach Brinell (neu): 0,416 GPa
177,8 kJ mol-1 (gasförmig)
154,9 J mol-1 K-1 (gasförmig)
Oberhalb von 450 °C ordnen sich die Ca-Atome hexagonal dicht an.
Externe Informationsangebote
Gruppenelemente - Informationen
Element-Halogen-Verbindungen der 2. Periode
Vortragsskript. Universität Bayreuth
Erdalkalimetalle
Gruppeneigenschaften. FH Münster - Format: PDF
Erdalkalimetalle
Vorlesungsmaterialien: Chemie der Metalle. Universität Freiburg
Gruppeneigenschaften der 2. Hauptgruppe
Zur Chemie der Erdalkalimetalle
Einzelne Verbindungen
Calcium-Chemikalien
Chemikalien-Datenbank: physikalische und chemische Eigenschaften, Sicherheitsdatenblätter, kommerziell verfügbaren Stoffen und Verbindungen; verschiedene Suchkriterien einschließlich Struktursuche
Analyse und Bestimmung
Calcium Analyse
Skript zur qualitativen anorganischen Analyse. Universität Köln - Format: PDF
Calcium Nachweis
Skript zur Qualitativen Anorganischen Analyse. Universität Münster - Format: PDF
Calcium Nachweis
Qualitative Analyse - Identifizierung von Elementen
Geochemie und Biogeochemie
Calciumhaltige Minerale
Informationen zum Calcium und den Calciummineralien. Mineralien Atlas
Newsarchiv
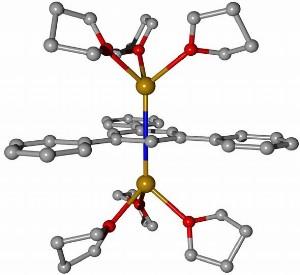
Chemiker der Universität Jena stellen erstmals einwertige Calcium-Verbindung her.
Abbildung: Modell der ersten einwertigen Calcium-Verbindung [Bildquelle: Matthias Westerhausen/FSU]
Neues zur Kristallisation von Kalk
Calciumcarbonat kristallisiert anders als bislang gedacht ...
Kategorie: Chemische Elemente
Aktualisiert am 31.01.2020.
Permalink: https://www.internetchemie.info/chemische-elemente/calcium.php
© 1996 - 2026 Internetchemie ChemLin