Natron ist die triviale und im Volksmund weit verbreitete Bezeichnung für die anorganische Verbindung mit dem chemischen Namen Natriumhydrogencarbonat bzw. Natriumbicarbonat.
Das Natriumhydrogencarbonat zählt zu den Salzen; es handelt sich um ein Natriumsalz der Kohlensäure. Strukturell setzt sich Natron pro Formeleinheit aus einem einfach positiv geladenen Natrium-Kation Na+ und einem einfach negativ geladenem Hydrogencarbonat-Anion HCO3- zusammen.
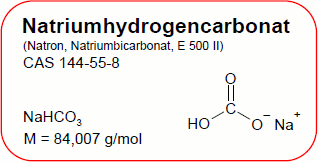
Bezeichnungen und Identifikatoren
Natron
CHNaO3
NaHCO3
84,006 (g/mol)
144-55-8
205-633-8
UIIMBOGNXHQVGW-UHFFFAOYSA-M
Weitere Bezeichnungen, Synonyme
Natriumhydrogencarbonat; Natriumhydrogenkarbonat; doppeltkohlensaures Natron; Natriumbicarbonat; Natriumbikarbonat; Backsoda
INCI-Bezeichnung
SODIUM BICARBONATE
Englische Bezeichnung
Sodium bicarbonate
Sodium hydrogencarbonate; Baking soda; Bicarb; Bicarbonate of soda; Natron
Sodium hydrogen carbonate
Handelsnamen; Präparate
Kaiser-Natron; Bullrich-Salz
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Natron:
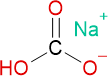
CHNaO3 oder NaHCO3
Mr = 84,0058 g/mol
SMILES: C(=O)(O)[O-].[Na+]
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Natron. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
In reinem Zustand ist Natron ein weißer, geruchloser, kristalliner Feststoff, der als Haushaltsnatron meist in gepulverter Form oder zu Tabletten gepresst in den Handel gelangt; oft erscheint die Substanz allerdings auch klumpig. Es weist einen leicht salzigen, alkalischen Geschmack auf, der dem von Soda (Natriumcarbonat) ähnelt. Bei trockener und kühler Lagerung kann Natron ohne nennenswerte zersetzung 2 bis 3 Jahre lang aufbewahrt werden.
Der pH-Wert einer frisch angesetzten 0,1-molaren NaHCO3-Lösung liegt bei 8,3 (25 °C).
Ab etwa 50 °C beginnt Natron Kohlendioxid zu verlieren und wird bei 100 °C vollständig in Natriumcarbonat umgewandelt.
+ Löslich in Wasser (siehe Tabelle unten).
- Unlöslich in Alkohol.
- Verteilungskoeffizient logP = -0,82.
> 50 °C
2,22 g cm-3 bei 20 °C
pK1s = 10,33
-950,8 kJ/mol bei 25 °C
101,7 J/(mol K)
-851,0 kJ/mol
87,6 J/(mol K)
Natriumhydrogencarbonat-Lösung
Die Tabelle zeigt einige Eigenschaften einer Natriumhydrogencarbonat-Lösung in reinem Wasser bei 20°C.
| Masse | Molalität | Molarität | Dichte | Brechungsindex | Gefrierpunkt | Viskosität |
|---|---|---|---|---|---|---|
| [%] | [mol kg-1] | [mol L-1] | [g cm-3] | n[D, 589 nm] | [°C] | [mPa s] |
| 0,5 | 0,060 | 0,060 | 1,0018 | 1,3337 | 0,20 | 1,015 |
| 1,0 | 0,120 | 0,120 | 1,0054 | 1,3344 | 0,40 | 1,028 |
| 1,5 | 0,181 | 0,180 | 1,0089 | 1,3351 | 0,59 | 1,042 |
| 2,0 | 0,243 | 0,241 | 1,0125 | 1,3357 | 0,78 | 1,057 |
| 2,5 | 0,305 | 0,302 | 1,0160 | 1,3364 | 0,98 | 1,071 |
| 3,0 | 0,368 | 0,364 | 1,0196 | 1,3370 | 1,16 | 1,086 |
| 3,5 | 0,432 | 0,426 | 1,0231 | 1,3377 | 1,35 | 1,102 |
| 4,0 | 0,496 | 0,489 | 1,0266 | 1,3383 | 1,54 | 1,118 |
| 4,5 | 0,561 | 0,552 | 1,0301 | 1,3390 | 1,72 | 1,134 |
| 5,0 | 0,627 | 0,615 | 1,0337 | 1,3396 | 1,90 | 1,151 |
| 5,5 | 0,693 | 0,679 | 1,0372 | 1,3403 | 2,08 | 1,168 |
| 6,0 | 0,760 | 0,743 | 1,0408 | 1,3409 | 2,26 | 1,185 |
Spektroskopische Daten:
Berechnetes NMR-Spektrum (Predict Spectra via NMRDB)
1H NMR Spektrum, 13C NMR Spektrum.
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Natron - CHNaO3 - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Kohlenstoff
12C: 12 u [98,94 %]
13C: 13,00335 u [1,06 %]
14C: 14,00324 u [<< 1 %]
12C: 14,14627 %
13C: 0,15156 %
14C: Spuren
Wasserstoff
1H: 1,00783 u [99,99 %]
2H: 2,0141 u [0,01 %]
3H: 3,01605 u [<< 1 %]
1H: 1,1998 %
2H: 0,00012 %
3H: Spuren
Natrium
22Na: 21,99444 u [<< 1 %]
23Na: 22,98977 u [100 %]
24Na: 23,99096 u [<< 1 %]
22Na: Spuren
23Na: 27,36689 %
24Na: Spuren
Sauerstoff
ΣAr = 47,997 u
16O: 15,99491 u [99,757 %]
17O: 16,99913 u [0,03835 %]
18O: 17,99916 u [0,205 %]
16O: 56,99652 %
17O: 0,02191 %
18O: 0,11713 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 84,00576928 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 11,904 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,012 mol.
Monoisotopische Masse: 83,9823381692 Da - bezogen auf 12C1H23Na16O3.
Wirkstoff Natron
Lateinische Bezeichnung: Natrii hydrogenocarbonas.
ATC-Code:A02AH01
D11AB14
B05CB04
B05XA02
Antacidum und Dermatikum. Bestandteil von medizinischen Salzlösungen und Elektrolytlösungen. Eine 1,3 %ige NaHCO3-Lösung ist mit Körperflüssigkeiten annähernd isotonisch.
Detail-Informationen zum Wirkstoff in englischer Sprache: Siehe unter DrugBank DB01390 (Wirkstoff-Datenbank), NCI Thesaurus C29457 (Wirkstoff-Beschreibung).
Verwendung in Lebensmitteln
E-Nummer: E500 (II)
Natriumhydrogencarbonat wird im Lebensmittelbereich hauptsächlich zur Herstellung von Backpulver bzw. Bachtriebmitteln sowie von Brausepulver verwendet.
EU: Status und Vorschriften siehe EU Food Additives DB Ref.-Nummer 3361.
Verwendung in Kosmetika
INCI-Bezeichnung: SODIUM BICARBONATE
Natron ist in der EU ein zugelassener Inhaltsstoff kosmetischer Mittel in der Funktion als abrasive, puffernde, desodorierende, mundpflegende und hautschützende Komponente.
Quelle: CosIng (Cosmetic Ingredient Database der EU) Nummer: 37736.
Pestizid
Natriumhydrogencarbonat ist als Pflanzenschutzmittel in der EU gelistet.
Status der EU-Zulassung: Siehe EU Pestizid-Datenbank ID 1235.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)
LD50 (Ratte, oral): 4220 mg/kg.
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.005.122 sowie Informationen zu REACh unter ECHA Chem 100.005.122.
Zur Toxikologie und zum Arbeitsschutz beim Umgang mit Natron sowie Maßnahmen im Gefahrenfall siehe: Gefahrstoffinformationssystem GESTIS, ZVG-Nr. 002440.
Weitere unfangreiche toxikologische Daten und Gefahrstoff-Informationen liefert die Datenbank für gefährliche Stoffe (Hazardous Substances Data Bank) unter der Nummer HSDB 697.
Internationales Sicherheitsdatenblatt (SDS, MSDS) siehe ICSC: 1044 [englisch].
Hinweis: Die Kennzeichnungspflicht gemäß CLP-Verordnung gilt unter anderem nicht für bestimmte Stoffe und Gemische für Endverbraucherinnen und Endverbraucher, die in Form von Fertigerzeugnissen vorliegen, wie zum Beispiel Arzneimittel, Tierarzneimittel, Kosmetika, bestimmte Medizinprodukte und medizinische Geräte, Lebensmittel oder Futtermittel sowie bestimmte Lebensmittelzusatzstoffe oder Aromastoffe. Hier sind gegebenenfalls gesonderte rechtliche Vorschriften einzuhalten.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Natron als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[0] - Fach- und Forschungsartikel in wissenschaftlichen Zeitschriften via PubMed: Sodium_bicarbonate.
Letzte Änderung am 28.02.2024.
Permalink: https://www.internetchemie.info/substanz/Natron.php
© 1996 - 2026 Internetchemie ChemLin