Bezeichnungen und Identifikatoren
Ammoniumchlorid
ClH4N
NH4Cl
53,489 (g/mol)
12125-02-9
235-186-4
NLXLAEXVIDQMFP-UHFFFAOYSA-N
Weitere Bezeichnungen, Synonyme
Ammoniummuriat; Ammoniaksalz; Lötstein; Salmiak
INCI-Bezeichnung
AMMONIUM CHLORIDE
Englische Bezeichnung
Ammonium chloride
Salmiac; Sal ammoniac; Ammonium muriate; Nushadir salt; Sal armagnac
azanium;chloride
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Ammoniumchlorid:
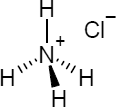
ClH4N oder NH4Cl
Mr = 53,489 g/mol
SMILES: [NH4+].[Cl-]
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Ammoniumchlorid. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
In reinem Zustand liegt Ammoniumchlorid als weißes, häufig klumpiges, geruchloses, salzig schmeckendes Pulver vor, das sich verflüchtigen und an kalten Oberflächen kondensieren kann.
+ Gut löslich in Wasser (372 g/L bei 20 °C), wenig in Alkohl ()6 g/L bei 19 °C)
- Unlöslich in Ether.
337,6 °C
337,6 °C
1,519 g cm-3 bei 20 °C
pK1s = 9,24
-314,6 kJ/mol
-36,7 × 10-6 cm3 mol-1
Spektroskopische Daten:
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Ammoniumchlorid - ClH4N - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Chlor
35Cl: 34,96885 u [75,80 %]
36Cl: 35,96831 u [<< 1 %]
37Cl: 36,9659 u [24,2 %]
35Cl: 50,23668 %
36Cl: Spuren
37Cl: 16,03862 %
Wasserstoff
ΣAr = 4,032 u
1H: 1,00783 u [99,99 %]
2H: 2,0141 u [0,01 %]
3H: 3,01605 u [<< 1 %]
1H: 7,53724 %
2H: 0,00075 %
3H: Spuren
Stickstoff
14N: 14,00307 u [99,6205 %]
15N: 15,00011 u [0,3795 %]
14N: 26,08731 %
15N: 0,09938 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 53,489 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 18,695 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,019 mol.
Monoisotopische Masse: 53,003226823051 Da - bezogen auf 35Cl1H414N.
Vorkommen
Ammoniumchlorid kommt natürlicherweise in vulkanischen Regionen vor und bildet sich auf vulkanischen Gesteinen in der Nähe von Rauch freisetzenden Öffnungen (Fumarolen). Die Kristalle scheiden sich direkt aus dem gasförmigen Zustand ab und sind eher kurzlebig, da sie sich leicht in Wasser auflösen und schnell vom Regen weggewaschen werden.
Verwendung
Die vorherrschende Anwendung von Ammoniumchlorid ist die als Stickstoffquelle in Düngemitteln (entsprechend 90 % der Weltproduktion von Ammoniumchlorid).
Darüber hinaus wird die Chemikalie als Flussmittel bei der Herstellung von Metallen verwendet, die mit Zinn beschichtet, galvanisiert oder gelötet werden sollen. Außerdem wirkt NH4Cl als Flussmittel es die Oberfläche von Werkstücken, indem es mit den Metalloxiden an der Oberfläche reagiert, um flüchtige Metallchlorid zu bilden. Zu diesem Zweck wird Ammoniumchlorid auch in Baumärkten in Form von Blöcken verkauft, um die Spitze eines Lötkolbens zu reinigen oder um die Substanz als Flussmittel in das Lot einzuarbeiten.
Wirkstoff Ammoniumchlorid
ATC-Code:G04BA01
B05XA04
Ammoniumchlorid ist ein systemisches harnansäuerndes Mittel aus der Gruppe der Urologika, das zur Aufrechterhaltung des pH-Werts beträgt und eine milde harntreibende Wirkung ausübt. Außerdem wirkt das Salz durch Reizung der Schleimhäute schleimlösend und wird zur Linderung von Husten eingesetzt.
Die Substanz wird als Additivum für intravenöse Elektrolytlösungen eingesetzt; eine 0,8 %ige Lösung ist mit dem Serum isoosmotisch.
Detail-Informationen zum Wirkstoff in englischer Sprache: Siehe unter DrugBank DB06767 (Wirkstoff-Datenbank), NCI Thesaurus C47396 (Wirkstoff-Beschreibung).
Verwendung in Lebensmitteln
E-Nummer: E510 (gestrichen)
Ammoniumchlorid ist in der EU per Definition kein Zusatzstoff und wird in der EU und in der Schweiz unter den entsprechenden Aromenverordnungen geführt. So müssen Lakritz mit einem Gehalt an Ammoniumchlorid (Salmiak) von mehr als 20 g/kg mit Hinweisen zum Schutz vor Gesundheitsrisiken gekennzeichnet werden.
Verwendung in Kosmetika
INCI-Bezeichnung: AMMONIUM CHLORIDE
In der EU zugelassener Inhaltsstoff kosmetischer Mittel in der Funktion als puffernde, duftende und viskositätsregelnde Komponente.
Quelle: CosIng (Cosmetic Ingredient Database der EU) Nummer: 31857.
Duftstoff, Aromastoff
Aromastoff in Lebensmitteln.
Ammoniumchlorid ist als Aromastoff und/oder Duftstoff in den einschlägigen Listen aufgeführt (siehe folgende Identifikatoren).
EU-Vorschriften: Siehe Datenbank für Lebensmittelaromen Ref.-Nr. 5847 (EU Food Flavourings Database)
16.048
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)

Signalwort: Achtung
Gefahrenhinweise (H-Sätze):
- H302
Gesundheitsschädlich bei Verschlucken. - H319
Verursacht schwere Augenreizung.
LD50 (Ratte, oral): 1650 mg/kg.
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.031.976 sowie Informationen zu REACh unter ECHA Chem 100.031.976.
Zur Toxikologie und zum Arbeitsschutz beim Umgang mit Ammoniumchlorid sowie Maßnahmen im Gefahrenfall siehe: Gefahrstoffinformationssystem GESTIS, ZVG-Nr. 001460.
Weitere unfangreiche toxikologische Daten und Gefahrstoff-Informationen liefert die Datenbank für gefährliche Stoffe (Hazardous Substances Data Bank) unter der Nummer HSDB 483.
Internationales Sicherheitsdatenblatt (SDS, MSDS) siehe ICSC: 1051 [englisch].
Beförderung gefährlicher Güter (Gefahrgut-Kennzeichnung): UN-Nummer 3077.
Hinweis: Die Kennzeichnungspflicht gemäß CLP-Verordnung gilt unter anderem nicht für bestimmte Stoffe und Gemische für Endverbraucherinnen und Endverbraucher, die in Form von Fertigerzeugnissen vorliegen, wie zum Beispiel Arzneimittel, Tierarzneimittel, Kosmetika, bestimmte Medizinprodukte und medizinische Geräte, Lebensmittel oder Futtermittel sowie bestimmte Lebensmittelzusatzstoffe oder Aromastoffe. Hier sind gegebenenfalls gesonderte rechtliche Vorschriften einzuhalten.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Ammoniumchlorid als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Letzte Änderung am 22.04.2024.
Permalink: https://www.internetchemie.info/substanz/Ammoniumchlorid.php
© 1996 - 2026 Internetchemie ChemLin