Ob Körperzellen krankhaft entarten, kann man im Prinzip schon auf ihrer Oberfläche anhand veränderter Zuckerverbindungen ablesen. Wissenschaftlern am Leibniz-Institut für Molekulare Pharmakologie (FMP) ist es nun gelungen, Zellen mit bestimmten Zuckerverbindungen mittels der neuartigen Xenon-Kernspintomographie zu lokalisieren. Das eröffnet die Möglichkeit, Krebs- und Entzündungsherde auch tief in den Gewebsschichten aufzuspüren.
Zu den charakteristischen Eigenschaften von Zellen gehören nicht nur Gene und Proteine, sondern auch Glykane - komplexe Zuckerverbindungen, mit denen ihre Oberflächen gespickt sind. Insgesamt neun verschiedene Einzelzucker werden hierfür auf unterschiedlichste Art zu verzweigten Molekülen oder auch längeren Ketten verknüpft und an Proteine und Lipide gehängt. Noch steht die Biologie erst am Anfang, den Glykan-Code zu entschlüsseln - doch schon länger ist bekannt, dass sich mit dem Einsetzen von Krebs oder Entzündungsprozessen auch die Struktur der Glykane auf den Zelloberflächen ändert. So findet man auf Tumorzellen beispielsweise vermehrt Sialinsäuren vor - und je mehr Sialinsäuren eine Krebszelle trägt, desto größer ist die Wahrscheinlichkeit für die Bildung von Metastasen.
Die Glykanmuster auf den Zellen zu erforschen, ist allerdings alles andere als einfach. Ein wichtiger Durchbruch bestand darin, bestimmte Glykane mit Fluoreszenzfarbstoffen zu markieren und dann Zellkulturen oder auch kleine durchscheinende Organismen wie Zebrafische mittels Lichtmikroskopie zu untersuchen. Dagegen gab es bislang kaum Möglichkeiten, diese auch im Körper eines Säugetiers zu lokalisieren. "Schon seit Jahren gab es Versuche, mit bestimmten Zuckerbausteinen markierte Glykane auch durch Kontrastmittel im Kernspintomographen sichtbar zu machen, doch mit den herkömmlichen Methoden sind sie nicht aufspürbar, weil sie nicht selektiv genug markiert werden konnten", sagt Chris Witte, einer der beiden Erstautoren der nun publizierten Arbeit. Mit der nun im renommierten Fachmagazin 'Angewandte Chemie' [siehe Hinweis unten] veröffentlichten Arbeit könnte sich das ändern: Darin gelang es den FMP-Forschern, in einem Modellsystem Zellen anhand markierter Sialinsäuren mittels Kernspintomographie zu lokalisieren. Möglich wurde dies durch die Zusammenarbeit der Arbeitsgruppen von Christian Hackenberger und Leif Schröder, die beide an dem interdisziplinären Leibniz-Institut forschen.
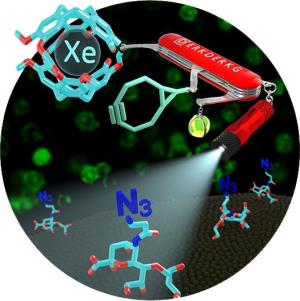
Schon länger entwickelt der Physiker Leif Schröder dort die potentiell bahnbrechende Xenon-Kernspintomographie. Bei der herkömmlichen Kernspintomographie nutzt man die Eigenschaft von Wasserstoffatomen aus, in starken Magnetfeldern selbst zu winzigen Magneten zu werden, die dann mit Radiowellen in Resonanz treten können und so Signale aussenden. Die Xenon-Kernspintomographie dagegen setzt als Signalgeber hyperpolarisiertes Xenon Edelgas ein, das 100.000-fach stärkere Signale als Wasserstoff aussendet und in Kombination mit Biosensoren zum molekularen Spürhund wird. In einer Reihe von Veröffentlichungen hat Leif Schröder bereits das Potential dieser Methode für klinische Anwendungen demonstriert - Patienten könnten einmal Xenon inhalieren, das ungiftige Edelgas würde sich dann über den Blutkreislauf im Körper verteilen.
Durch die Zusammenarbeit mit dem Chemiker Christian Hackenberger ist nun klargeworden, dass sich die Xenon-Kernspintomographie auch dafür eignet, Glykane in undurchsichtigen größeren Organismus zu erforschen. Hackenberger setzte dafür Methoden der bioorthogonalen Chemie ein - damit bezeichnet man chemische Veränderungen an Biomolekülen, die in lebenden Zellen oder sogar in Tieren durchgeführt werden können. In dem Versuch erhielten die Zellen in Kulturschalen zunächst für einige Tage ein besonderes Nährmedium - es enthielt den gewöhnlichen Zucker Mannose, der aber durch eine Azidgruppe chemisch modifiziert war. Die so veränderte Mannose wird von den Zellen ganz normal verstoffwechselt und in Glykane wie Sialinsäuren eingebaut.
Nun fügten die Forscher eine zweite Komponente hinzu: "Dieser molekulare Sensor reagiert quasi auf Knopfdruck und geht eine spezifische und feste Verbindung mit der Azidgruppe an der Sialinsäure ein", erklärt die zweite Erstautorin Vera Martos. An diesen Sensor hatten die Chemiker wiederum ein käfigartiges Molekül geheftet, das Xenon-Atome einfängt. Das Resultat: Die markierten Zellen leuchteten im Xenon-Kernspintomographen auf und es entstanden Aufnahmen, in denen sich markierte Zellen von anderen deutlich im Kontrast abgrenzten - aufgenommen mittels Magnetfeld und Radiowellen. Zwar wurden die Zellen bisher nur in einer eigens gebauten Apparatur lokalisiert, die als Modell für ein Organ oder einen ganzen Organismus dient. Trotzdem zeigt das Experiment deutlich das Potenzial der Methode, die Glykanmuster auch in Versuchstieren wie beispielsweise in Mäusen zu orten. "Denkbar ist, dass wir die Entwicklung entarteter Zellen innerhalb der Tiere verfolgen werden", spekuliert Leif Schröder. "Auf diese Weise könnte man einmal mehr über die Rolle der Glykane herausfinden."
Das Leibniz-Institut für Molekulare Pharmakologie (FMP) gehört zum Forschungsverbund Berlin e.V. (FVB), einem Zusammenschluss von acht natur-, lebens- und umweltwissenschaftlichen Instituten in Berlin. In ihnen arbeiten mehr als 1.500 Mitarbeiter. Die vielfach ausgezeichneten Einrichtungen sind Mitglieder der Leibniz-Gemeinschaft. Entstanden ist der Forschungsverbund 1992 in einer einzigartigen historischen Situation aus der ehemaligen Akademie der Wissenschaften der DDR.
[Text: Birgit Herden]
Zusatzinformationen:
Dr. Christopher Witte, Dr. Vera Martos, Dr. Honor May Rose, Dr. Stefan Reinke, Stefan Klippel, Dr. Leif Schröder und Prof. Dr. Christian P. R. Hackenberger:
Xenon-MRT an lebenden Zellen mit Hyper-CEST-Biosensoren für metabolisch markierte Glykane an der Zelloberfläche.
In: Angewandte Chemie; online veröffentlicht am 09. Februar 2015, DOI 10.1002/ange.201410573
Quelle: Leibniz-Institut für Molekulare Pharmakologie, FMP, Berlin
Aktualisiert am 16.02.2015.
Permalink: https://www.internetchemie.info/news/2015/feb15/glykane-xenon-mrt.php
© 1996 - 2026 Internetchemie ChemLin