Die Funktion von Proteinen, die in Zellen vielfältige Aufgaben erfüllen, wird häufig in wässrigen Pufferlösungen untersucht. Unklar ist aber, beispielsweise bei pharmazeutischen Studien, ob sie in diesen Lösungen genauso funktionieren wie in ihrer natürlichen Umgebung: Die Zellflüssigkeit ist dicht gepackt mit Biomolekülen, organischen und anorganischen Stoffen. Bochumer Forscher um Juniorprofessor Dr. Simon Ebbinghaus haben jetzt gezeigt, dass das Wasser, das die gelösten Substanzen im Zellinneren umgibt, eine entscheidende Rolle bei der Proteinstabilität spielt, die bisher oft vernachlässigt worden ist.
Über ihre Ergebnisse, die sie mit einfachen Modellsystemen und thermodynamischen Untersuchungen gewonnen haben, berichten die Forscher im Journal of the American Chemical Society [siehe Artikelverweis unten]. Die Ergebnisse entstammen einer Kooperation im Rahmen des Exzellenzclusters RESOLV. Sie wurden zudem mit einem Hot-Topic Posterpreis auf der diesjährigen Bunsentagung in Hamburg ausgezeichnet.
Arbeitsumgebung der Proteine ist zähflüssiger als Eiweiß
Proteine gehören zu den wichtigsten und meistuntersuchten Biomolekülen der biochemischen Forschung. Sie haben strukturelle Aufgaben und sind die molekularen Maschinen der Zelle, die chemische Reaktionen katalysieren, Stoffwechselprodukte transportieren und Signalstoffe erkennen. Fehler in der Proteinfunktion führen deshalb oft zu schweren Erkrankungen wie z.B. Huntington und Alzheimer. Die natürliche Arbeitsumgebung der Proteine in der Zelle ist eine hoch-konzentrierte Lösung (zähflüssiger und konzentrierter als Eiweiß), die aus verschiedenen Makromolekülen sowie kleinen organischen und anorganischen Stoffen besteht. Um die Funktion von Proteinen mit modernen analytischen Methoden untersuchen zu können, werden sie gezielt aus dieser Umgebung herausgelöst und in verdünnte wässrige Lösungen gegeben. Oftmals ist jedoch unklar, inwieweit die experimentellen Ergebnisse dann noch die wirkliche Funktion in der zellulären Umgebung reflektieren.
Theorie: Proteine legen in der Enge 'die Ellenbogen an'
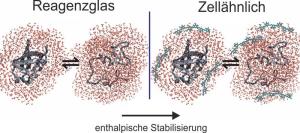
Eine häufig verwendete Methode um den Effekt der dichtgepackten zellulären Umgebung auf Proteine vorherzusagen ist die "Excluded Volume"-Theorie. Sie lässt sich anschaulich anhand eines alltäglichen Phänomens verstehen. In einem vollen Aufzug oder einer vollen Straßenbahn versucht jeder den direkten Kontakt mit seinen Nachbarn zu vermeiden und eine möglichst kompakte Körperhaltung einzunehmen (z.B. durch Anlegen der Arme). Das Prinzip der gegenseitigen Abstoßung lässt sich nach der "Excluded Volume"-Theorie auf Proteine in dicht gedrängter zellulärer Umgebung anwenden. Sie nehmen eine kompakte Struktur ein. In der Regel ist ihr biologisch aktiver Zustand auch zugleich der kompakteste Zustand, weshalb die "Excluded Volume"-Theorie eine Stabilisierung des biologisch aktiven Zustands voraussagt.
Studie zeigt, dass mehr wirkt als nur gegenseitige Abstoßung
Mit Hilfe verschiedener Lösungsmittelzusätze wie Biomakromolekülen, Zuckern und Salzen haben die RUB-Forscher jetzt die unterschiedlichen zellulären Bedingungen imitiert und deren Einfluss auf das Modellprotein Ubiquitin analysiert. Dabei konnten sie zeigen, dass das Verhalten des Proteins nicht nur von der gegenseitigen Abstoßung zwischen Protein und Lösungsmittelzusatz bestimmt ist. Thermodynamische Studien halfen unterschiedliche Stabilisierungs- und Destabilisierungsmechanismen aufzudecken. Im Gegensatz zu der erwarteten sogenannten entropischen Stabilisierung - basierend auf dem "Excluded Volume"-Effekt - beobachteten die Forscher eine sogenannte enthalpische Stabilisierung von Ubiquitin in der Gegenwart von Makromolekülen, Zuckern und Salzen. Diese enthalpische Stabilisierung steht in direktem Zusammenhang mit der Verstärkung chemischer Bindungen des biologisch aktiven Zustands und lässt sich nicht über eine rein volumenbasierte kompaktere Gestalt des Proteins erklären.
Wasser als Mittler zwischen Protein und gelösten Substanzen
Die Forscher führen das enthalpische Stabilisierungsphänomen auf einen Wasser-vermittelten Prozess zurück: Protein und Lösungsmittelzusatz wechselwirken nicht direkt miteinander, jedoch führen die veränderten Wassereigenschaften im Hydratwasser der Lösungsmittelzusätze zu einer Optimierung von Wasserstoffbrückenbindungen im biologisch aktiven Zustand des Proteins. Die Arbeiten wurden durch das Rückkehrerprogramm des Ministeriums für Innovation, Wissenschaft und Forschung des Landes NRW, den Exzellenzclusters RESOLV und den Verband der Chemischen Industrie e.V. (VCI) gefördert.
Zusatzinformationen:
Michael Senske, Lisa Törk, Benjamin Born, Martina Havenith, Christian Herrmann und Simon Ebbinghaus:
Protein Stabilization by Macromolecular Crowding through Enthalpy Rather Than Entropy.
In: Journal of the American Chemical Society; 136 (25), pp 9036 - 9041; online veröffentlicht am 03. Juni 2014, DOI 10.1021/ja503205y
Quelle: Ruhr-Universität Bochum, RUB
Aktualisiert am 09.07.2014.
Permalink: https://www.internetchemie.info/news/2014/jul14/hydratwasser-proteinstabilitaet.php
© 1996 - 2026 Internetchemie ChemLin