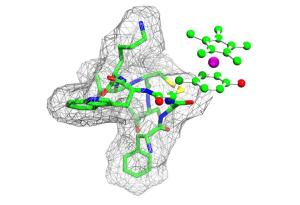
Forscher der RUB und aus Berkeley haben aus Aminosäuren bestehende Hormone durch Metallkomplexe modifiziert.
In der Zeitschrift Journal of the American Chemical Society [siehe unten] berichten sie erstmals auch über die dreidimensionale Struktur der dabei entstehenden Metall-Peptid-Verbindungen.
"Damit legen wir die molekulare Grundlage für die Entwicklung besserer Medikamente", sagt Prof. Raphael Stoll von der Fakultät für Chemie und Biochemie der Ruhr-Universität.
Das Team untersuchte Hormone, die Schmerzwahrnehmung und Tumorwachstum beeinflussen.
Peptidhormone haben viele Funktionen im Körper
Aus Aminosäuren bestehende Hormone, die Peptidhormone, vermitteln im Körper Gefühle wie Schmerz und Hunger, übermitteln aber auch Wachstumssignale. Ein Beispiel ist das für den Zuckerhaushalt wichtige Insulin. Im Zusammenspiel mit speziellen Rezeptoren, den G-Protein-gekoppelten Rezeptoren, transportieren die Peptidhormone ihre Botschaften in die Zellen. Die Hormone lassen sich gezielt chemisch modifizieren, so dass sich ihre Wirkung ändert, beispielsweise das Schmerzempfinden verringert oder das Tumorwachstum hemmt. Die deutsch-kalifornische Forschergruppe hat nun eine neue Methode gefunden, Peptidhormone zu modifizieren.
Metallkomplexe reagieren mit verschiedenen Peptidhormonen
Erstmals nutzten sie einen Metallkomplex, nämlich eine Rhodiumverbindung, die mit der Aminosäure Tyrosin reagiert. Das Edelmetall Rhodium wird als Katalysator bei der Synthese von hochkomplizierten Arzneistoffen im Forschungslabor ebenso eingesetzt wie in großtechnischen Anlagen. Die Forscher analysierten unter anderem das Peptidhormon Enkephalin, das für das Schmerzempfinden wichtig ist, und Octreotid. Letzteres ist ein synthetischer, als Arzneistoff zugelassener Abkömmling des Wachstumshormons Somatostatin, welcher heute schon in der Tumorbehandlung eingesetzt wird. Die Reaktion mit dem Metallkomplex war hochselektiv. Obwohl die Hormone aus über hundert Atomen bestehen, band die Rhodiumverbindung immer an einen Kohlenstoffring des Tyrosins - den Phenolring.
Struktur aufgeklärt
Das Team klärte auch die Struktur der entstandenen Metall-Petid-Komplexe auf. "Wir hoffen, aufbauend auf diesen grundlegenden Untersuchungen weitere metallhaltige, peptidartige Wirkstoffe zu entwickeln", sagt Prof. Dr. Nils-Metzler-Nolte vom Lehrstuhl für Anorganische Chemie I. "Diese könnten die Wirkung natürlich vorkommender Peptidhormone modulieren und beispielsweise als neuartige Mittel gegen Schmerz oder Krebserkrankungen eingesetzt werden." Für das Projekt stellten die kalifornischen Kollegen ihr Wissen über die spezielle Reaktivität der Rhodiumverbindung zur Verfügung. Die Bochumer brachten ihre Erfahrung mit Metall-Peptiden, den zugehörigen Rezeptoren und der Strukturaufklärung biologischer Makromoleküle ein. "Hier zeigt sich erneut, dass hochaktuelle kompetitive Forschung nur im Forschungsverbund effizient durchgeführt werden kann", sagt Prof. Stoll.
Die Deutsche Forschungsgemeinschaft (SFB 642 und Forschergruppe 630) und das Research Department für Grenzflächen-Systemchemie (Interfacial Systems Chemistry) unterstützten die Arbeiten.
Zusatzinformationen:
H. Bauke Albada, Florian Wieberneit, Ingrid Dijkgraaf, Jessica H. Harvey, Jennifer L. Whistler, Raphael Stoll, Nils Metzler-Nolte, Richard H. Fish:
The Chemoselective Reactions of Tyrosine-Containing G-Protein-Coupled Receptor Peptides with [Cp*Rh(H2O)3](OTf)2, Including 2D NMR Structures and the Biological Consequences.
In: Journal of the American Chemical Society; 134 (25), pp 10321 - 10324, online veröffentlicht am 07. Juni 2012, DOI 10.1021/ja303010k
Quelle: Ruhr-Universität Bochum, RUB
Aktualisiert am 06.07.2012.
Permalink: https://www.internetchemie.info/news/2012/jul12/metall-peptid-komplexstruktur.php
© 1996 - 2026 Internetchemie ChemLin