
Eine Puppe in der Puppe und noch eine drumherum - so erklärt Thomas Fässler seine Moleküle: Er packt ein Atom in einem Käfig in noch ein weiteres Atomgerüst.
Mit ihrer großen Oberfläche könnten solche Strukturen als hocheffiziente Katalysatoren dienen.
Wie bei dem russischen Holzspielzeug sitzt ganz innen drin ein einzelnes kleines Zinnatom, eingepackt in eine Hülle aus zwölf Kupferatomen, und diese ist nochmals umgeben von weiteren 20 Zinnatomen.
In der Arbeitsgruppe von Professor Fässler am Institut für Anorganische Chemie der Technischen Universität München (TUM) gelangen solche aus drei Schalen aufgebauten räumlichen Strukturen als isolierte Metallcluster in Legierungen zum ersten Mal.
Faszinierend sind vor allem die Bilder, mit denen die Forscher diese Verbindungen und ihre Eigenschaften erläutern - im Labor ist das ein eher unspektakuläres, schwarz-graues, feines Pulver, aber die Strukturmodelle sind farbig und in den verschiedensten verschachtelten Formen. Was man damit machen kann? Mit ihrer großen Oberfläche sind solche Pulver interessant als Vorstufen für Katalysatoren, die Wasserstoff übertragen. Ähnliche Gerüste aus Silicium könnten in Solarzellen das Sonnenlicht noch effektiver einzufangen.
Metalle stellt man sich als gleichmäßige, von der Struktur her unspektakuläre Werkstoffe vor. Ganz anders die Metallverbindungen an Fässlers Institut: Auf dem Tisch stapeln sich die verschiedensten Käfigmodelle in bunten Farben, mit gelben Kugeln, die Kupferatome symbolisieren, und blauen für Zinn. Die Parallelität zu den Kohlenstoffbällen, die als "Buckyballs" Furore machten, ist offensichtlich. Auch hier gibt es geometrische Formen, aus Dreiecken, Fünf- und Sechsecken zusammengesetzte Körper, jedoch nicht aus Kohlenstoff: Auch schwerere Metallatome wie Zinn und Blei können solche isolierten Käfigstrukturen bilden.
"Es sind grundsätzlich andere als die gewohnten Formen von Legierungen, die uns beschäftigen", sagt Thomas Fässler. Metalllegierungen wie Bronze, jene schon früh entdeckte Mischung aus Kupfer und Zinn, nach der eine ganze Epoche benannt wurde, sind kristallin aufgebaut; die Atome dieser beiden Komponenten sind im ganzen Kristall regelmäßig verteilt und dicht gepackt.
Ganz anders die neuen Bronzen aus dem Hause Fässler: Im Labor schmolz die Doktorandin Saskia Stegmaier besonders reine Formen von Kupferdraht und Zinnkörnchen zusammen, allerdings unter besonderen Bedingungen: vor Luft und Feuchtigkeit geschützt in einer Argonatmosphäre. Die so erhaltene Bronze schweißte sie dann zusammen mit einem Alkalimetall wie Kalium in eine Ampulle aus Tantal ein. Dieses Metall schmilzt erst bei etwa 3.000 Grad Celsius und eignet sich deshalb besonders, um darin andere Metalle ungestört miteinander in Kontakt zu bringen.
So entstanden die neuen, wie die russische Holzpuppe ineinander geschachtelten Metallcluster: Beim Erhitzen der Bronze mit Kalium oder Natrium auf 600 bis 800 Grad Celsius wirken die Alkalimetalle zunächst wie eine Schere, die das Gitter der Legierung auftrennt, sich dann zwischen die Stücke drängt und kleine isolierte Atomcluster stabilisiert. Denn eigentlich sind diese Clusterteilchen gar nicht in der Lage, sich regelmäßig und dicht zu stapeln und damit Kristalle zu bilden. Sie sind als Fünfecke aus insgesamt 20 Zinnatomen zusammengebaut, daraus lässt sich kein regelmäßig wiederkehrendes Muster aufbauen. Erst "mit etwas Schummeln" und den Kaliumatomen als "Klebstoff" dazwischen entsteht auch daraus ein normal anmutender Kristall. Für die Entdeckung ähnlicher, sogenannter Quasikristalle mit fünfzähliger Symmetrie, erhielt der Israeli Dan Shechtman im vorigen Jahr den Chemie-Nobelpreis.
"Unsere Cluster sind kleine Einheiten, quasi Atomhaufen ohne Verbindung zu ihren Nachbarn". Damit sind sie ideal für katalytische Anwendungen: "Weil sie alle gleich groß sind", erklärt Fässler, "können sie bestimmte chemische Reaktionen viel exakter steuern als klassische Katalysatoren". Ein Beispiel sind Hydrierungsreaktionen, bei denen Wasserstoffatome an organische Molekülketten mit Sauerstoffatomen angedockt werden, etwa zur Synthese von Aromastoffen. Üblich sind hier teure Edelmetalle wie Rhodium - aber polare neuartige Legierungen aus Magnesium, Cobalt und Zinn können die gleichen Erfolge liefern. "Was wir für effiziente Reaktionen brauchen, ist eine sehr große Oberfläche des Katalysators." Die bekommt man auf klassische Weise, wenn man Lösungen zweier Metallsalze zusammenkippt, damit aus der Lösung feinste Nanoteilchen ausfallen. "Das ergibt aber ein ganzes Spektrum von Teilchengrößen", erläutert Fässler. "Mit Metallclustern könnten wir den richtigen Katalysator quasi maßschneidern."
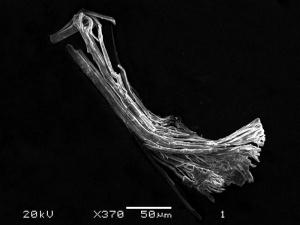
In ihrem Reaktionsgefäß fanden Stegmaier und Fässler aber noch mehr: Neben den Clustern sahen sie ein faserartiges Material, wie dünne Nadeln, die sich an den Enden etwas biegen ließen. "Wir haben geahnt", sagt Stegmaier, "dass da noch etwas Spannendes drin sein muss". Inzwischen konnte die Ausbeute dieser Fasern verbessert werden - durch Natrium als Schere zum Auftrennen der Bronze. Dabei entstehen anstelle von Kugeln nun mehrschalige Röhren: in der Mitte ein Strang von Zinnatomen, darum eine Röhre aus Kupferatomen, um diese wieder ein Röhrchen aus Zinnatomen. Wie die hohlen Matrjoschka-Moleküle an Buckyballs erinnern, so erinnern die neuartigen Fasern mit ihren Röhren an die Kohlestoff-Nanoröhrchen. Entsprechend könnten solche Fasern einmal als molekulare Drähte mit den unterschiedlichsten elektrischen Eigenschaften Anwendung finden.
Zusatzinformationen:
Dipl.-Chem. Saskia Stegmaier, Prof. Dr. Thomas F. Fässler:
A Crystalline Alloy Featuring Intermetalloid. Double-Walled Nanorods with Pseudo-Five-Fold Symmetry.
In: Angewandte Chemie; online veröffentlicht am 01. Februar 2012, DOI 10.1002/ange.201107985
Saskia Stegmaier and Thomas F. Fässler:
A Bronze Matryoshka: The Discrete Intermetalloid Cluster [Sn@Cu12-@Sn20]12– in the Ternary Phases A12Cu12Sn21 (A = Na, K).
In: Journal of the American Chemical Society; J. Am. Chem. Soc., 2011, 133 (49), pp 19758–19768, DOI 10.1021/ja205934p
Quelle: Technische Universität München, TUM
Aktualisiert am 07.02.2012.
Permalink: https://www.internetchemie.info/news/2012/feb12/matrjoschka-molekuele.php
© 1996 - 2026 Internetchemie ChemLin