In jeder unserer Körperzellen und zwischen den einzelnen Zellen laufen permanent Transportvorgänge über Distanzen von einigen Nanometern bis zu mehreren Millimetern. Eins dieser zellulären 'Frachtunternehmen' arbeitet mit so genannten molekularen Motoren, die sich an den Filamenten des zellulären Skeletts (Zytoskelett) regelrecht entlang hangeln.
Britische Forscher haben sich davon inspirieren lassen.
In der Zeitschrift Angewandte Chemie [siehe unten] beschreiben sie die Entwicklung einer molekularen 'Trasse', auf der sich ein kleines Molekül wie ein Läufer hin- und herbewegen kann.
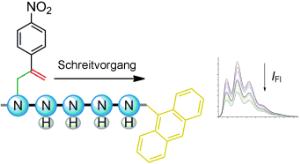
David A. Leigh und ein Team von der Universität Edinburgh (Großbritannien) stellten die Trasse aus einem so genannten Oligoethylenimin her. Die Aminogruppen des Strangs stellen die 'Trittsteine' für den molekularen 'Läufer' dar. Der Läufer ist ein kleines Molekül (a-Methylen-4-nitrostyrol). Dieses Molekül sieht fast wie ein Strichmännchen aus mit einem aromatischen Kohlenstoffsechsring als Bauch, einer Nitro-Gruppe als Kopf und zwei kurzen Kohlenwasserstoff-Beinen. Mit einem 'Bein' ist es zunächst an den ersten Trittstein der Trasse gebunden. Das 'Loslaufen' des molekularen Läufers beginnt mit einer Umlagerung unter Ringschluss (intramolekulare Michael-Reaktion) - das zweite Bein bindet an den benachbarten Trittstein. Eine zweite Umlagerungsreaktion unter Ringöffnung (retro-Michael-Reaktion) bewirkt dann, dass sich das erste Bein von seinem Trittstein löst. Auf diese Weise kann der molekulare Läufer Schritt um Schritt entlang der Trasse auf Wanderschaft gehen.
Die Sache hat allerdings einen Haken: Alle diese Umlagerungsreaktionen sind Gleichgewichtsreaktionen. Sind die Trittsteine chemisch gleichwertig, schwankt der winzige Läufer hin und her, hebt ein Bein, senkt es wieder, geht einen Schritt vor, einen Schritt wieder zurück, seine Bewegung folgt keiner vorgegebenen Richtung. Aber er schafft im Durchschnitt die erstaunlich hohe Zahl von 530 'Schritten', bevor er sich vollständig von der Trasse löst. Das ist wesentlich mehr, als natürliche Systeme wie Kinesin-Motorproteine schaffen.
Der kleine Läufer kann sogar einen Job erledigen: An das Ende einer Trasse mit fünf Trittsteinen knüpften die Forscher eine Anthracen-Gruppe. Solange der Läufer am Anfang der Strecke bleibt, fluoresziert diese. Erreicht er jedoch das Anthracen-bestückte Trassenende, kommt es zu einer elektronischen Wechselwirkung zwischen Läufer und Anthracen, die Fluoreszenz wird dadurch 'ausgelöscht'. Die Forscher fanden, dass die Intensität der Fluoreszenz nach und nach auf etwa die Hälfte sank. Nach ca. 6,5 Stunden war der Endwert, das heißt der Gleichgewichtszustand zwischen allen möglichen Läuferpositionen erreicht.
Nächstes Ziel des Teams ist die Entwicklung eines Läufers, der unter Verbrauch von 'Treibstoff' gezielt in eine vorgegebene Richtung marschiert und dabei Lasten über längere, verzweigte Trassen transportiert.
Über den Autor
Professor David Leigh hat den Forbes-Lehrstuhl für Organische Chemie an der Universität von Edinburgh inne. Er ist einer der international führenden Forscher auf dem Gebiet der künstlichen molekularen Motoren und Maschinen und wurde mehrfach ausgezeichnet, unter anderem mit der Mitgliedschaft in der Royal Society (britische Akademie der Wissenschaften) und dem Feynman Award for Nanotechnology. Seine Gruppe wird im Herbst 2012 an die Universität von Manchester umziehen.
Zusatzinformationen:
Dr. Araceli G. Campana, Dr. Armando Carlone, Dr. Kai Chen, Dr. David T. F. Dryden, Prof. David A. Leigh, Urszula Lewandowska, Dr. Kathleen M. Mullen:
A Small Molecule that Walks Non-Directionally Along a Track Without External Intervention.
In: Angewandte Chemie; online veröffentlicht am 05. April 2012, DOI 10.1002/ange.201200822
Quelle: Angewandte Chemie, Pressemitteilung Nr. 15/2012
Aktualisiert am 26.04.2012.
Permalink: https://www.internetchemie.info/news/2012/apr12/molekularer-zweibeiner.php
© 1996 - 2026 Internetchemie ChemLin