Von der Katalyse über Nervenleitung, von der Wachstumskontrolle bis hin zur mechanischen Stützfunktion: Proteine stehen im Zentrum praktisch aller biologischen Prozesse. Längst hat man deren Potential auch in Technologiefeldern wie der Medizin und den Materialwissenschaften erkannt.
Aber nicht für alle Anforderungen gibt es entsprechende natürliche Proteine, und Methoden zur Herstellung maßgeschneiderter Proteine sind bislang stark begrenzt.
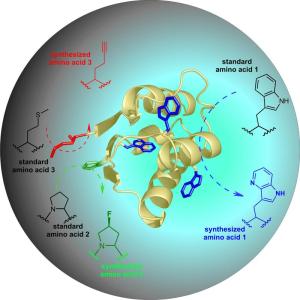
Jetzt ist es einem Team um Prof. Dr. Nediljko Budisa gelungen, ein Protein gleichzeitig mit drei verschiedenen neuartigen Eigenschaften auszustatten.
So wurde mit einer Aminosäure ein fluoreszierender Chromophor mit blauer Fluoreszenz eingeführt, und eine weitere eingebaute Aminosäure sorgt für eine verbesserte Stabilität. Die dritte synthetische Aminosäure stattet das Protein mit einer Gruppe aus, die eine weitere Konjugation des Proteins mit Zucker- und Polyethylenglykol-Molekülen ermöglicht.
Dadurch eröffnen sich viele praktische Anwendungsmöglichkeiten zum Beispiel im Bereich der Einzelmolekülspektroskopie, der Enzymkatalyse, der Zellbiologie bis hin zur Biotechnologie und der synthetischen Biologie. "Zweifelllos wird auch der Wirtschaftsstandort Deutschland von der Weiterentwicklung des Verfahrens zum Beispiel für die Herstellung von Antibiotika, industriell relevanter Enzyme, Antikörper und anderer Proteine sehr stark profitieren", sagt der Biochemiker Budisa.
Nediljko Budisa ist neu berufener Professor für Biokatalyse im Exzellenz-cluster "Unifying Conepts in Catalysis" (UniCat) an der TU Berlin. Er wech-selte im Mai dieses Jahres vom Max-Planck-Institut für Biochemie von München nach Berlin. In den letzten 17 Jahren etablierte und entwickelte Budisa das Fachgebiet "Engineering des genetischen Codes" in Deutschland, also den Einbau von künstlichen Aminosäuren in Proteine. Das noch immer relativ junge Forschungsfeld erlangt weltweit immer mehr Anerkennung und eine stetig wachsende Zahl an Arbeitsgruppen beginnt, sich damit zu beschäftigen.
Mit gentechnologischen Methoden lassen sich komplexe Proteine in großer Reinheit leicht herstellen. Natürliche Organismen können jedoch nur 20 Aminosäuren zum Aufbau ihrer Eiweißmoleküle verwenden, weil der genetische Code auf diese beschränkt ist. Ihn zu erweitern ist daher eine vielversprechende Perspektive zur Synthese neuartiger Proteine.
Budisas Ergebnisse wurden am 24. Juni 2010 in der renommierten Fachzeitschrift Angewandte Chemie veröffentlicht [siehe unten].
"Unifying Concepts in Catalysis" (UniCat) ist der einzige Exzellenzcluster, der das volkswirtschaftlich wichtige Gebiet der Katalyse erforscht. In diesem interdisziplinären Forschungsverbund arbeiten mehr als 250 Chemiker, Physiker, Biologen und Verfahrenstechniker aus vier Universitäten und zwei Max-Planck-Instituten aus Berlin und Brandenburg zusammen. UniCat wird von der Deutschen Forschungsgemeinschaft mit Mitteln aus der Exzellenzinitiative mit ca. 5,6 Millionen Euro jährlich gefördert.
Zusatzinformationen:
Dr. Sandra Lepthien, Dr. Lars Merkel, Prof. Dr. Nediljko Budisa:
Doppelte und dreifache In-vivo-Funktionalisierung von Proteinen mit synthetischen Aminosäuren.
In: Angewandte Chemie; Online-Veröffentlichung vom 23. Juni 2010, DOI 10.1002/ange.201000439
Quelle: Technische Universität Berlin
Aktualisiert am 05.07.2010.
Permalink: https://www.internetchemie.info/news/2010/jul10/kuenstliche-proteine.php
© 1996 - 2026 Internetchemie ChemLin